La production de biomédicaments commence par le développement de micro-organismes produisant la molécule d’intérêt. Ces micro-organismes modifiés sont l’infrastructure centrale des entreprises biotechnologiques et pharmaceutiques du domaine des biomédicaments. De fait, elles sont protégées et non partagées. C’est pour cela qu’Open Insulin Foundation France doit développer les siennes même si des organismes similaires existent déjà.
Le choix des insulines cibles
Open Insulin Foundation France a choisi de travailler sur trois insulines : insuline glargine, insuline lispro et l’insuline asparte.
Ces insulines ont été choisi sur les critères suivants :
- Les brevets sur les molécules sont arrivés à expiration ;
- Elles sont commercialisées en France ;
- Elles représentent 80 % des insulines vendues en pharmacie.
| Types d’insulines | Vitesses d’action | Sanofi-Aventis | Novo Nordisk | Eli Lilly |
| insuline glargine | action lente |
|
|
|
| insuline asparte | action rapide |
|
|
|
| insuline lispro | action rapide |
|
|
Types d’insulines : correspond au nom générique de la molécule, aussi dit principe actif.
Colonne 3 à 5 : les noms commerciaux utilisés lors de la mise sur le marché par les trois principaux producteurs d’insuline dans le monde.
Revue rapide de la production industrielle d’insuline.
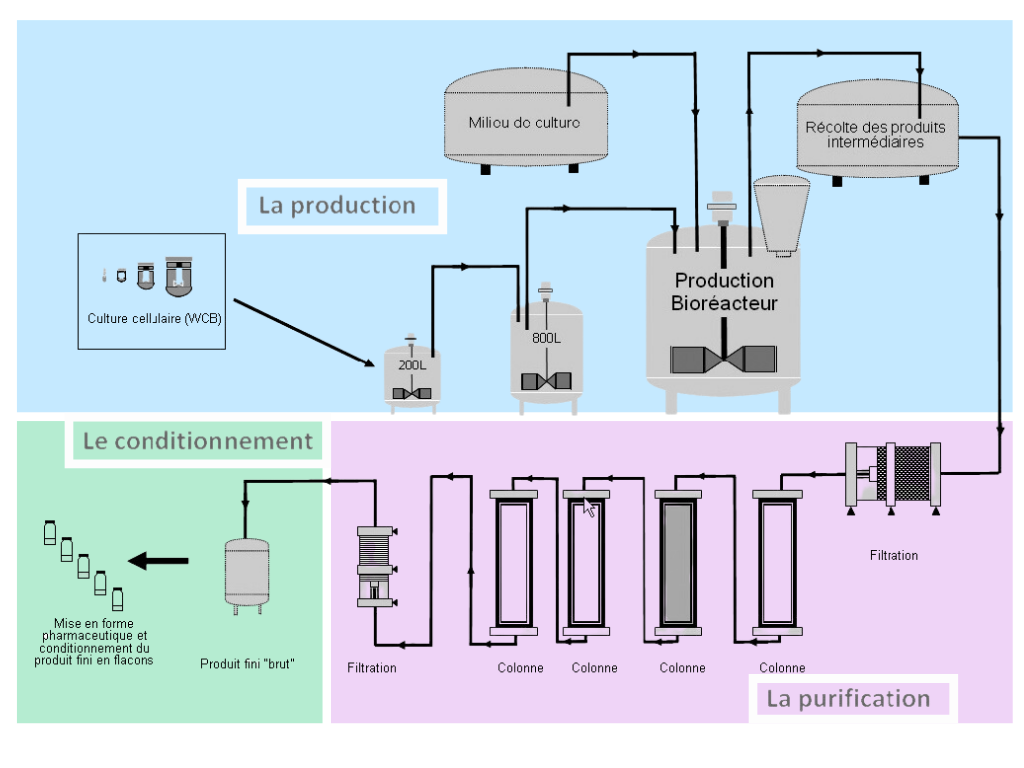
Pour mieux comprendre les choix stratégiques de la recherche biotechnologique, il est utile d’avoir en tête les grandes étapes de la fabrication d’insuline.
La production :
- les micro-organismes modifiés produisant l’insuline sont mis en culture dans un bioréacteur, dans lequel ils sont mélangés avec un milieu de culture (mix contenant l’ensemble des nutriments nécessaires à leur développement) à une température optimale ;
- cette étape prend de quelques jours à une ou deux semaines.
La purification :
- la purification consiste à séparer l’insuline et les contaminants (autres protéines, extraits cellulaires, milieux de culture) ;
- plusieurs étapes permettent d’éliminer chacun des différents types de contaminants ;
- cette étape marque aussi une transformation du produit de la proinsuline en insuline, grâce à des enzymes ;
- L’étape finale consiste à obtenir des cristaux d’insuline.
Le conditionnement :
- pour l’insuline, le conditionnement peut se faire en fiole ou en cartouche pour stylo ;
- c’est l’étape importante pour s’assurer de la stérilité du produit final.
Ref : https://www.academie-medecine.fr/comment-securiser-les-traitements-par-les-biomedicaments/
L’objectif est d’obtenir une quantité maximale d’insuline à pouvoir mettre en conditionnement en bout de chaîne. Pour cela, il faut s’assurer d’avoir un volume de matière le plus élevé possible au sortir de la production et une réduction la plus faible possible à l’issue de la purification. La production dans le bioréacteur étant constante, le rendement de la souche (cellule) utilisée est l’élément déterminant. Seul un rendement élevé de l’ordre de 1 g d’insuline par litre de souche permet d’envisager une production industrielle.
Le choix de la stratégie de production.
Il existe une littérature abondante sur la production d’insuline et de nombreuses stratégies ont été testées. Les informations sur les protocoles de production peuvent être trouvées dans des publications scientifiques, dans les brevets sur les processus de fabrication, et dans les documents de demande d’autorisation de mise sur le marché. Il s’agit ensuite de rassembler ces informations et de faire ses propres choix stratégiques.
L’équipe d’Open Insulin Foundation France a choisi de se baser sur les développements les plus récents et déjà testés au niveau industriel. Un des derniers acteurs à proposer un nouveau système de production de l’insuline et à obtenir des autorisations sur le marché américain et européen est l’entreprise pharmaceutique indienne Biocon, spécialisée dans les biosimilaires. Biocon a choisi de produire l’insuline à partir d’un système de levure. Ce système est largement utilisé pour d’autres biomédicaments et il est utilisé en routine au niveau industriel. Il a émergé dans les années 1990 et a amené à l’utilisation de la souche Pichia Pastoris dans les années 2010. C’est sur cette levure que s’appuie Biocon. À titre de comparaison, Sanofi utilise le système de bactérie (avec Escherichia Coli).
Il existe toutefois des limitations puisque Biocon a breveté une partie de son processus de fabrication. Biocon a développé une stratégie de co-production de l’insuline et de l’enzyme qui transforme la pro-insuline en insuline, réduisant les étapes de purification. Ce nouveau processus est plus performant, mais n’est pas accessible pour le moment.
Une grande partie des choix sur la stratégie de production doit être faite en amont, avant même le début des expérimentations. Un changement dans la stratégie de production implique en général de reprendre l’ensemble du processus depuis le début. C’est ce qui explique en partie pourquoi la recherche est longue et souvent imprévisible.
La recherche et développement.
Une fois que la stratégie de production a été choisie, il est possible de passer en laboratoire et de commencer le processus de modification des micro-organismes. L’objectif est d’obtenir une souche qui produit (on dit aussi “exprime”) l’insuline en grande quantité. Pour cela, on a besoin de deux types de matériaux biologiques :
- une souche de levure Pichia Pastoris ;
- une séquence d’ADN (appelé plasmide) avec l’information génétique de l’insuline et d’autres informations nécessaires pour la production.
À notre connaissance, il n’est pas possible d’acquérir une souche de Pichia Pastoris sous licence libre qui permet la libre commercialisation et les échanges avec des tiers. C’est pourquoi nous utilisons la souche que nous avons isolée et mise à disposition dans notre centre de ressource openCRB.
Après avoir inséré le morceau d’ADN dans la levure, on va mesurer la quantité d’insuline produite. Si le processus d’introduction d’ADN est très bien connu, le résultat reste aléatoire. Il faut donc répéter le processus des centaines ou des milliers de fois pour obtenir un “bon” résultat, c’est-à-dire un rendement d’au moins 1 g d’insuline par litre de culture. Open Insulin Foundation France utilise un système semi-automatisé grâce à un robot pipeteur qui lui permet de tester une centaine de transformants par semaine.
Caractérisation de l’insuline.
Dire si l’insuline est active et de bonne qualité, c’est le rôle de la caractérisation qui s’intéresse à ses aspects biophysique ou fonctionnel.
Cette caractérisation de l’insuline passe par un ensemble de tests dont voici une liste non-exhaustive composée de techniques de biophysique et de biochimie :
- chromatographie avec HPLC : mesure la pureté de l’échantillon et l’homogénéité ;
- test de cristallisation : étape de purification et confirmation de la pureté et de l’homogénéité de l’échantillon ;
- ELISA : test fonctionnel où l’insuline se fixe à un anticorps spécifique ;
- test sur des souris diabétiques.
En parallèle de la caractérisation, commence la partie dite de “scale up”. Celle-ci rassemble les étapes pour aller de la production en laboratoire à partir de quelques millilitres jusqu’à la production industrielle avec des centaines de milliers de litres. En dehors du changement d’échelle, les conditions sont tout à fait différentes et demandent des ajustements spécifiques. OIFF réalise les premiers tests avec un bioréacteur de quelques litres. Cette partie comprend aussi la mise au point d’un protocole de transformation de la pro-insuline produite par les levures à l’insuline pure injectable. Ces étapes sont ensuite adaptées pour une production au niveau industriel.
L’établissement du laboratoire à Nantes.
Pour mener l’ensemble des étapes décrites ci-dessus, OIFF s’est doté d’un laboratoire de recherche en biologie qui ouvrira ses portes en septembre 2023 à Nantes. Ce laboratoire contient les équipements nécessaires au projet d’OIFF. Voici le calendrier prévisionnel des étapes décrites dans les paragraphes précédents :
- septembre – octobre 2023 : mise en place du protocole de modification des micro-organismes pour établir un processus semi-automatisé ;
- octobre 2023 – septembre 2024 : réalisation du criblage des micro-organismes pour obtenir un micro-organisme avec le rendement adéquat ;
- printemps 2024 : mise au point d’un protocole de purification et transformation de l’insuline ;
- été 2024 : mise en place des tests pour la caractérisation de l’insuline ;
- automne 2024 : réalisation des premiers tests en bioréacteurs.
L’objectif est d’obtenir des premiers résultats concluants courant 2024.
Ce calendrier sera soumis à des aléas vu qu’il implique la mise en place de processus nouveaux. La caractérisation de l’insuline et sa transformation a déjà été étudiée dans les laboratoires d’Open Insulin Foundation à Oakland et Baltimore. Il reste à transposer ces tests et s’assurer qu’ils fonctionnent. La semi-automatisation devra être développée, elle n’a pas encore été mise en place dans le cadre d’Open Insulin.
Inscrivez-vous à la newsletter Open Insulin Foundation France via le formulaire en pied-de-page.